Antistolling
Antistolling
Meer dan één miljoen mensen in Nederland gebruiken enige vorm van antistolling ter preventie en/of behandeling van een trombotische aandoening. De ‘traditionele’ vormen van antistolling en antibloedplaatjestherapie worden besproken evenals de nieuwe generatie antistollingsmiddelen.
Vitamine-K-antagonisten
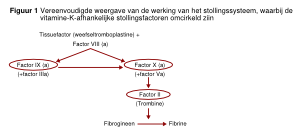
Er zijn in Nederland twee cumarinederivaten, ook bekend als vitamine K antagonisten, geregistreerd. Dit zijn acenocoumarol (Sintrom) en fenprocoumon (Marcoumar). Beide medicijnen hebben hetzelfde werkingsmechanisme. Dit werkingsmechanisme berust op remming van het vitamine K metabolisme en daarmee de synthese van de vitamine K afhankelijke stollingsfactoren. De viamine K afhankelijke stollingsfactoren zijn: protrombine (factor II), factor VII, IX en X (zie figuur 1). Daarnaast worden ook proteine-S en -C geremd. De indicaties voor beide medicijnen zijn hetzelfde (zie tabel 1). Voor de verschillende indicaties zijn optimale antistollingsintensiteiten vastgesteld in verschillende onderzoeken. Deze antistollingsintensiteiten worden uitgedrukt in de international normalized ratio (INR). De INR is gebaseerd op de protrombinetijd en daarmee een afspiegeling van een tekort aan protrombine, factor VII en X. Controle van de INR en aanpassen van de dosering gebeuren in Nederland door de trombosedienst. Er zijn 62 trombosediensten in Nederland, verenigd in de Federatie van Nederlandse Trombosediensten. Er worden internationaal twee target INR ranges aangehouden. De eerste target range (INR 2,0-3,0) wordt aangehouden voor vrijwel alle indicaties en de tweede target range (INR 2,5-3.5) wordt gebruikt voor mechanische kunstkleppen. Ook de contra-indicaties zijn voor beide medicijnen gelijk. De meeste contra-indicaties zijn relatief en dienen te worden afgewogen tegen de indicatie voor de vitamine K antagonisten (zie tabel 2). Cumarinederivaten zijn mogelijk teratogeen en worden dan ook afgeraden in de zwangerschap en vooral in het eerste trimester. Na de 36e week wordt het gebruik eveneens afgeraden vanwege bloedingscomplicaties tijdens en na de bevalling (ook bij de baby). Borstvoeding tijdens het gebruik van cumarinederivaten is geen probleem als het kind bij de borstvoeding de algemeen gebruikelijke dosering van vitamine K oraal krijgt toegediend.
Acenocoumarol
De halfwaardetijd van acenocoumarol ligt tussen acht en 11 uur. De werking is maximaal na 36-48 uur na het starten van de medicatie, en na het staken houdt de werking nog ongeveer 48 uur aan. Er zijn verschillende startschema’s voor acenocoumarol in gebruik. Vaak wordt gestart met een dosering van 6 mg op dag 1, 4 mg op dag twee en 2 mg op dag drie, waarna op dag 4 de INR wordt bepaald en aan deze waarde de dosering wordt aangepast. De onderhoudsdosering is afhankelijk van veel verschillende zaken, waaronder dieet en comedicatie. Ook is de onderhoudhoudsdosering inter- en intra-individueel zeer verschillend. Daarnaast is de beoogde target INR range van belang voor de noodzakelijke dosis. Er moet daarom met enige regelmaat een INR worden bepaald. Uiteindelijk zal de dosering van acenocoumarol meestal tussen 1 en 8 mg per dag liggen. Bijwerkingen van acenocoumarol zijn misselijkheid, diarree en dermatitis (jeuk). Zelden treedt haaruitval op. Tenslotte is vooral in het begin van de medicatietoediening bij patiënten met ernstige proteine-C- of proteine-S-deficientie purpura fulminans (met huidnecrose) beschreven. Dit is echter zeer zeldzaam.
Fenprocoumon
De halfwaardetijd van fenprocoumon is langer dan van acenocoumarol en bedraagt ongeveer 160 uur. De werking is maximaal na 48-72 uur na het starten van de medicatie. Na het staken van de medicatie houdt de werking nog ongeveer een tot twee weken aan. Er zijn verschillende startschema’s voor fenprocoumon in gebruik. Meestal wordt begonnen met een dosering van 6 mg op dag 1, 3 mg op dag twee, en 3 mg op dag drie, steeds in een dagelijkse dosering, waarna de INR wordt bepaald op dag 4 en aan deze waarde de dosering wordt aangepast. De onderhoudsdosering is afhankelijk van veel verschillende zaken, zoals dieet en comedicatie. Ook bij fenprocoumon is de onderhoudsdosering inter- en intra-individueel zeer verschillend. Daarnaast is de beoogde INR-range van belang voor de noodzakelijke dosis. Uiteindelijk zal de dosering van fenprocoumon meestal tussen 1,5 en 6 mg per dag liggen. Misselijkheid, diarree en dermatitis (jeuk) kunnen als bijwerking optreden. Zelden wordt haaruitval gemeld. Incidenteel treedt hepatitis op, welke reversibel is. Tenslotte is vooral bij het starten van de medicatietoediening bij patiënten met ernstige proteine-C- of proteine-S-deficientie purpura fulminans (met huidnecrose) beschreven. Dit is echter zeer zeldzaam.
Heparine
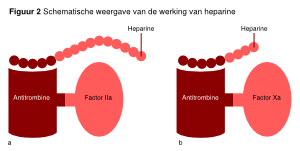
In Nederland zijn op dit moment twee soorten heparine beschikbaar, namelijk ongefractioneerde heparine en laagmoleculairgewicht heparine (LMWH). Gemeenschappelijk aan deze middelen is dat de werking berust op binding van deze middelen aan het circulerende anticoagulans antitrombine (AT). Door deze directe binding aan AT wordt de anticoagulante werking van AT met een factor 500 versterkt. In deze verhoogde activiteitsvorm is AT zeer effectief in de remming van twee belangrijke stollingsfactoren, namelijk factor Xa en factor IIa (trombine). De belangrijkste verschillen tussen ongefractioneerde heparine en LMWH worden veroorzaakt door het verschil in ketenlengte van de polysachariden in deze middelen. Hierdoor ontstaat er een verschil in antistollingswerking, biologische beschikbaarheid, toediening en halfwaardetijd. Ongefractioneerde heparine bevat veel langeketenpolysachariden en heeft een hoog gemiddeld molecuulgewicht. De lange ketens van ongefractioneerde heparine zorgen voor binding van AT aan zowel factor Xa als factor IIa en geven een 1:1 remming van factor Xa en Factor IIa. LMWH bevat alleen de korte ketens van ongefractioneerde heparine (chemisch geknipt). Deze kortere ketens van LMW-heparine resulteren in een geringere factor IIa-remming dan factor Xa-remming door AT, in een ratio van ongeveer 1:3, en leiden dus tot een iets selectievere remming van het stollingssysteem (zie figuur 2). Contra-indicaties voor LMWH en heparine gelden vooral voor therapeutische doseringen en minder stringent voor profylaxe. De eventuele contra-indicaties zullen per patiënt moeten worden geëvalueerd (zie tabel 3).
Ongefractioneerde heparine
Dit wordt intraveneus toegediend en de werking zet direct na toediening in. Door binding aan velerlei plasma-eiwitten is een oplaaddosering noodzakelijk om snel een therapeutisch niveau te bereiken. Er is veel variatie in dosering tussen patiënten en binnen 1 patiënt over de tijd door deze niet selectieve binding. De therapeutische halfwaardetijd ligt tussen 1 en 2 uur. Er wordt gestart met een intraveneuze bolus van 60 IE/kg (of 5000 IE), onmiddellijk gevolgd door een continue infusie van 1000 IE/uur. Na zes uur volgt er een controle met behulp van een aPTT en zo nodig bijstelling van continue infusie (zie tabel 4). Vervolgens zijn regelmatig controles van de aPTT nodig. De korte therapeutische halfwaardetijd en de mogelijkheid de werking te couperen met protamine maken ongefractioneerde heparine zeer geschikt in de aanloop naar invasieve ingrepen. Tot kort voor de ingreep is hierdoor therapeutische antistolling mogelijk. Tevens kan het middel worden toegediend bij patiënten met een hoog bloedingsrisico en een indicatie voor antistollingstherapie. Nadelen van heparine zijn de zeer variabele plasmaconcentraties, de frequente controles van de aPTT, de noodzaak tot intraveneuze toediening en de kans op antistofvorming (HIT).
Heparine wordt toegepast bij noodzaak tot: • snelle uitwerking van antistolling (voor operaties of andere invasieve ingrepen en bij een hoog bloedingsrisico); • tijdelijke antistolling bij patiënten met kunstkleppen; • antistolling tijdens hemodialyse, percutane coronaire interventie (PCI) of coronary-artery bypass graft (CABG).
Bijwerkingen zijn bloedingen (hematurie, hematomen) en trombocytopenie. Zelden treden op: allergie (erythemen, asthma bronchiale, koorts, collaps, vaatkrampen), reversibele haaruitval, huidnecrose, priapisme, leverfunctiestoornissen en hyperkaliemie.
Laagmoleculairgewicht heparine (LMWH)
LMWH wordt subcutaan toegediend. Therapeutische plasmaspiegels worden ongeveer twee uur na toediening bereikt. De therapeutische halfwaardetijd is ongeveer 12 uur (bij Fraxodi® 24 uur). Injecties vinden een- of tweemaal daags plaats (bij profylaxe éénmaal daags). De dosering wordt afgestemd op het gewicht van de patiënt (bij profylaxe is er een standaarddosering). De adequate dosering verschilt per LMWH. Bij de behandeling van acute coronaire syndromen wordt tevens gestart met een intraveneuze oplaaddosis. Het toedieninggemak, de stabiele antistollingsniveaus en de afwezige noodzaak tot controle (zoals aPTT bij ongefractioneerde heparine) hebben ertoe geleid dat voor zeer veel indicaties waarbij voorheen ongefractioneerde heparine de standaardtherapie was, nu LMWH wordt toegepast. Daarnaast is LMWH bij uitstek geschikt voor thuisbehandeling van trombose. Nadelen van LMWH zijn de lange halfwaardetijd, slechts gedeeltelijk te couperen met protamine en kans op antistofvorming (HIT).
Het middel wordt toegepast ter: • preventie van veneuze trombo-embolie; • initiële behandeling van veneuze trombo-embolie; • behandeling van acute coronaire syndromen (instabiele angina pectoris, non-ST-elevatie-myocardinfarct).
Bijwerkingen zijn bloedingen (hematurie, hematomen) en trombocytopenie. Zelden worden allergie (erythemen, asthma bronchiale) en leverfunctiestoornissen gezien.
Verkrijgbaar zijn: dalteparine (Fragmin®), enoxaparine (Clexane®), nadroparine (Fraxiparine®, Fraxodi®) en tinzaparine (Innohep®).
Danaparoïde
Een speciale plaats moet worden ingeruimd voor danaparoide (Orgaran®). Dit middel behoort tot de klasse van LMWH (in feite is het een ‘heparinoide’), maar onderscheidt zich door een sterke anti-factor Xa versus anti-factor IIa activiteit. De plaats van danaparoide is vooral als alternatief voor LMWH in geval van HIT-antistoffen of allergische reacties. De dosering bij preventie van trombose is 2 maal daags 750 IE subcutaan (s.c.) en bij behandeling van trombose 2500 IE als intraveneuze (i.v.) bolus (als gewicht < 55 kg: 1250 IE en als gewicht 90 kg 3750 IE), gevolgd door 400 IE/uur in de eerste vier uur, 300 IE uur volgende vier uur en vervolgens 200 IE/uur. Na enkele dagen kan worden overgegaan op 3 dd 750 IE subcutaan. Controle van stollingstijden is bij therapeutische doses niet nodig. Desgewenst kan een anti-factor-Xa-concentratie worden gemeten.
Antibloedplaatjestherapie
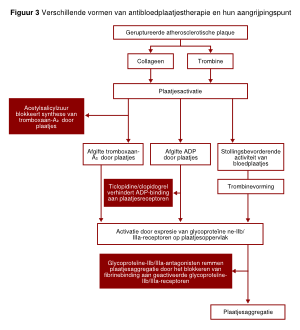
Bloedplaatjesaggregatie kan op drie manieren worden geremd (zie figuur 3), namelijk met: acetylsalicylzuur/carbasalaatcalcium, clopidogrel of prasugrel en IIb/IIIa-receptorantagonisten.
Acetylsalicylzuur/carbasalaatcalcium
De werking van acetylsalicylzuur berust op een irreversibele remming van cyclo-oxygenase (COX). Hierdoor wordt de omzetting van arachidonzuur naar tromboxaan-A2 onmogelijk gemaakt. Tromboxaan-A2 is een belangrijke agonist van de plaatjesaggregatie en is bovendien een vasoconstrictor. Aangezien versterking van bloedplaatjesactivatie door tromboxaan-A2 slechts een van de vele manieren is om tot bloedplaatjesaggregatie te komen, is het effect van acetylsalicylzuur op de bloedplaatjes relatief zwak. Desondanks heeft behandeling met Aspirine of Ascal duidelijk positieve effecten op de (secundaire) preventie van vooral arteriële trombose. Het antibloedplaatjeseffect van acetylsalicylzuur is dosisonafhankelijk. Tegenwoordig wordt over het algemeen een dosis acetylsalicylzuur van 80 tot 100 mg (in Amerika tot 375 mg) gebruikt. De bijwerkingen van acetylsalicylzuur zijn gastro-intestinale problemen (gastritis en ulceratie) en bloedingen. Deze bijwerkingen zijn wel dosisafhankelijk: hoe lager de dosis, des te kleiner is de kans op een bijwerking. Acetylsalicylzuur en andere NSAID’s remmen zowel cyclo-oxygenase-1 (COX-1) als COX-2. Tegenwoordig zijn er selectieve COX-2-remmers op de markt. Deze hebben een iets gunstiger bijwerkingenpatroon, dat wil zeggen minder gastro-intestinale bezwaren. Of deze middelen een gunstig effect hebben bij de preventie van trombotische aandoeningen is onduidelijk.
Clopidogrel/prasugrel
Clopidogrel (Plavix®) is het prototype van de klasse van thienopyridinederivaten. Clopidogrel is een oraal middel, waarvan vooral de door de lever geproduceerde metabolieten biologisch actief zijn. Het bloedplaatjesremmende effect van clopidogrel berust op antagonisme van de ADP-receptor op bloedplaatjes. Clopidogrel is een effectief antihemostatisch middel in een dosering van 75 mg eenmaal daags. In een groot onderzoek (CAPRIE) bleek het in geringe mate effectiever dan acetylsalicylzuur voor secundaire preventie van atherotrombotische aandoeningen bij patiënten met coronair lijden, cerebrovasculair lijden en perifeer vaatlijden. Met clopidogrel werden minder gastro-intestinale bijwerkingen gezien. Bij bijwerkingen van acetylsalicylzuur of carbasalaatcalcium kan clopidogrel dan ook worden overwogen. De combinatie van acetylsalicylzuur en clopidogrel is zeer effectief bij het voorkomen van occlusie van coronaire stents, voor secundaire preventie bij patiënten met ernstig coronair lijden en na coronaire interventies (CURE studie). De combinatie is superieur aan het geven van alleen acetylsalicylzuur bij hoog risico patiënten. Zeldzame maar ernstige bijwerkingen van thienopyridinederivaten zijn het ontstaan van trombocytopenie of zelfs trombocytopenische trombotische purpura. Dit kwam overigens vooral voor bij de voorloper van clopidogrel, ticlopidine, een middel dat in Nederland niet meer wordt gebruikt. Bij clopidogrel zijn deze bijwerkingen zeer zeldzaam. Clopidogrel leidt wel tot een lichte toename van het bloedingsrisico. Acuut couperen van het antihemostatische effect is mogelijk door transfusie van bloedplaatjes.
Glycoproteïne-IIb/IIIa-receptorantagonisten
Het prototype van remmers van de glycoproteine-IIb/IIIa-receptor is de gehumaniseerde monoklonale antistof abciximab. Glycoproteine-IIb/IIIa-receptorantagonisten competeren met fibrinogeenbinding aan de bloedplaatjes-IIb/IIIa-receptor en kunnen daarmee bloedplaatjesaggregatie volledig blokkeren. Uit grote onderzoeken met dit middel is de effectiviteit aangetoond van remming van de glycoproteine-IIb/IIIa-receptor bij patiënten die coronaire angioplastiek al dan niet in combinatie met stentplaatsing ondergaan. Gebaseerd op dit succes en gezien de potentiële nadelen van infusie met een bij muizen opgewekte monoklonale antistof in combinatie met de relatief hoge prijs zijn inmiddels vele andere middelen ontwikkeld die eveneens in staat zijn de glycoproteine-IIb/IIIa-receptor te remmen. Deze middelen zijn effectief bij patiënten die (gecompliceerde) percutane coronaire revascularisatie procedures ondergaan. Orale glycoproteine-IIb-IIIa-receptorantagonisten zijn uitgebreid onderzocht in fase-III-onderzoeken. Tot op heden zijn deze geneesmiddelen niet succesvol gebleken in de secundaire preventie bij patiënten met atherotrombotische ziekten. Sommige onderzoeken laten zelfs een nadelig effect van deze behandeling zien. De belangrijkste bijwerking van glycoproteine-IIb-IIIa-antagonisten is een bloeding. Zeker in combinatie met andere anticoagulantia (zoals gebeurt bij intracoronaire interventies) is er een sterk verhoogd bloedingsrisico. Bij ernstige bloedingen is alleen bloedplaatjestransfusie effectief. Bij de monoklonale antistof (abciximab) kunnen (zelden) ook allergische of anafylactische reacties optreden of kan een immuungemedieerde trombopenie ontstaan.
Trombolytica
Antistollingsmiddelen zoals vitamine-K-antagonisten en heparine(derivaten) zijn in staat de stolling te remmen en de progressie van trombose te voorkomen. Deze medicamenten hebben echter geen belangrijke trombolytische eigenschappen. Oplossen van het stolsel gebeurt door het endogene fibrinolytische systeem. Als een snellere oplossing van het stolsel noodzakelijk is, kan trombolytische therapie worden gegeven. Trombolytica zijn plasminogeenactivatoren (zie figuur 4) dan wel endogene activatoren (tissue-type plasminogen activator (t-PA) of urokinasetype plasminogen activator (u-PA)) Deze middelen kunnen of recombinant zijn vervaardigd of het zijn exogene plasminogeenactivatoren (zoals streptokinase) en kunnen in farmacologische doseringen worden toegediend (zie tabel trombolytica). Trombolytica zijn uiterst effectief bij de noodzaak tot snelle stolseloplossing, bijvoorbeeld bij acuut myocardinfarct, levensbedreigende longembolie, acuut ischemisch herseninfarct of getromboseerde shunts. De belangrijkste bijwerking van trombolyse is (ernstige) bloeding. De kans op deze bijwerking dient bij de afweging om trombolyse voor een bepaalde indicatie te gebruiken zeker te worden meegenomen. De kans op een intracerebrale bloeding varieert tussen 0,5% (bij patiënten met een hartinfarct) en 2% bij patiënten met veneuze trombo-embolie. In de regel is het beter een fibrinespecifiek trombolyticum te gebruiken. Alle in Nederland gebruikte trombolytica (met uitzondering van urokinase) zijn fibrinespecifiek. Streptokinase is een lichaamsvreemd eiwit en kan (zeker bij eerdere blootstelling) ernstige allergische reacties veroorzaken. Alle andere beschikbare trombolytica zijn lichaamseigen of recombinant en daarbij is de kans op een allergische reactie zeer gering. In geval van ernstige bloeding dient de toediening van het trombolyticum direct te worden gestaakt. Toediening van plasma, fibrinogeenconcentraat en antifibrinolytica in hoge doseringen is in deze situatie gedeeltelijk effectief en kan worden overwogen.
Nieuwe anticoagulantia
Tot enkele jaren geleden was het arsenaal van anticoagulantia zeer overzichtelijk. Er was ongefractioneerde heparine (UFH) of laagmoleculairgewichtheparine (LMWH) en er waren vitamine-K-antagonisten (VKA). Belangrijke nadelen van bijvoorbeeld VKA gaven echter ruimte voor verbeteringen. Bij de nieuwe anticoagulantia kan onderscheid worden gemaakt tussen middelen die aangrijpen op de initiatie fase van de stollingscascade (zoals tissuefactor/factor-VIIa-complex), de acceleratie fase van de stollingscascade (zoals factor Xa, maar ook de cofactoren van de Xa-generatie) en uiteindelijk de trombineactivatie (zie figuur 5). Een ander onderscheid is te maken tussen directe en indirecte remmers. Hierbij werken de directe (trombine- en factor Xa-)remmers onafhankelijk en de indirecte remmers (synthetische pentasachariden) net als heparinen afhankelijk van het endogene anticoagulante antitrombine. Over het algemeen kunnen indirecte remmers (inhibitors) subcutaan worden geven, terwijl directe remmers in orale vorm beschikbaar zijn. In de regel is bij deze nieuwe anticoagulantia (als de nier- en leverfunctie goed is) geen monitoring nodig. Veelal werken deze nieuwe middelen direct na inname en behoort daarmee ook het onderscheid tussen de initiële en de vervolgfase van de te starten therapie, zoals nu met LMWH en VKA, tot het verleden. Het ligt in de rede dat dit alles patiënt vriendelijker is en mogelijk het aantal ziekenhuisopnamen en de zorgbehoefte zal verminderen. Het is vooralsnog niet duidelijk welke benadering de meeste effectiviteit en veiligheid zal opleveren. Mogelijk zal dit ook verschillen voor diverse klinische indicaties van antistolling. Zo zou op theoretische gronden remming van het tissuefactor/factor-VIIa-complex het effectiefst kunnen zijn bij preventie en behandeling van acute arteriële trombose op een gescheurde atherosclerotische plaque, omdat hierbij expressie van tissuefactor (weefseltromboplastine) door geactiveerde monocyten en macrofagen een belangrijke rol lijkt te spelen. Voor veneuze trombo-embolie (VTE) echter zou remming lager in de stollingscascade mogelijk effectiever zijn. Gespeculeerd wordt wel over een mogelijk reboundmechanisme van trombinegeneratie bij het stopzetten van de therapie met trombineremmers, hetgeen zou kunnen leiden tot meer events direct na het stoppen van de therapie. Uiteindelijk moeten deze overwegingen worden getoetst in vergelijkend klinisch onderzoek. Het ontwikkelen van nieuwe anticoagulantia is niet eenvoudig, zowel ten aanzien van effectiviteit (meestal in een non-inferiority design) als ten aanzien van veiligheid (toxiciteit en bloedingen). Zo werd de veelbelovende orale directe trombineremmer ximelagatran in de laatste fase van het onderzoek wegens levertoxiciteit van de markt gehaald. De optimale duur van behandeling bij VTE blijft ook met deze nieuwe middelen een lastig punt. Wel hebben grote studies vaak extensieonderzoeken, die het middel versus placebo doorzetten na de nu gangbare duur van behandeling. Dit kan bijdragen tot het antwoord op deze moeilijke vraag. De meeste onderzoeken hebben echter een korte follow-up na het stoppen met de behandeling, waardoor een eventueel catch-up-fenomeen niet aan het licht komt en nieuwe events met langer behandelen slechts worden uitgesteld.
Remmers van de initiatie van de stolling
Voor de remming van het tissuefactor/factor-VIIa-complex zijn momenteel drie manieren. De eerste manier via de recombinant-tissue factor pathway inhibitor (TFPI) is tot op heden vooral in klinische onderzoeken bij patiënten met systemische stollingsactivatie en sepsis bestudeerd. Uit doseringsonderzoeken bleek de effectiviteit van dit middel bij het remmen van trombinegeneratie in vivo, maar een placebo gecontroleerd onderzoek toonde geen daling van sterfte bij met recombinant-TFPI behandelde patiënten ten opzichte van de controle patiënten groep. De tweede mogelijkheid is geïnactiveerd factor VIIa. Dit is recombinant factor VIIa, waarvan het reactieve centrum geblokkeerd is door een chemische verbinding. Hierdoor kan dit middel wel aan weefselfactor binden, maar verder geen katalytische activiteit uitoefenen, zodat een competitieve remming van het endogene actieve factor VII ontstaat. Geïnactiveerd factor VIIa wordt tot op heden vooral onderzocht bij patiënten die een percutane coronaire interventie ondergaan. De resultaten van deze onderzoeken zijn nog niet gepubliceerd. Tenslotte is de recombinante versie van het uit het speeksel van de ‘hookworm’ afkomstige anticoagulans NAPc2 (recombinant nematode anticoagulant protein) een potente remmer van het tissuefactor/factor-VIIa complex in aanwezigheid van factor Xa. Hierdoor zou theoretisch vooral antitrombotische activiteit op plaatsen van verhoogde stollingsactiviteit ontstaan. Van deze drie is deze laatste manier waarschijnlijk het meest belovend. Onderzoeken ter preventie van veneuze trombose na orthopedische chirurgie en arteriële trombose bij electieve PTCA suggereren dat r-NAPc2 een effectief en veilig antistollingsmiddel is. Het kan eenmaal per 48 uur subcutaan worden toegediend. Niettemin gaat de meeste aandacht op dit moment uit naar de nieuwe anticoagulantia die de volgende fasen in de stollingscascade van acceleratie en trombinegeneratie beïnvloeden.
Remmers van de acceleratie van de stolling
Specifieke factor-Xa-remming lijkt een aantrekkelijk aangrijpingspunt. Hiervan bestaan intussen zowel parenterale als orale vormen. Daarnaast is zijn er orale trombine remmers beschikbaar.
Subcutane factor-Xa-remmers: Pentasachariden (fondaparinux en idraparinux)
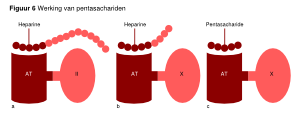
Pentasachariden zijn synthetische middelen die specifiek factor Xa remmen via selectieve binding aan antitrombine. Pentasachariden hebben een goede biologische beschikbaarheid na subcutane toediening en een voorspelbare farmacokinetiek, zodat laboratoriumcontrole van de intensiteit van antistolling niet noodzakelijk is (tenzij er een gestoorde nierfunctie is met een creatinineklaring 30 ml/min). De twee pentasachariden die in klinische onderzoeken zijn bestudeerd, zijn fondaparinux en idraparinux. Beide bevatten de vijf suikers aanwezig in heparine die de interactie met antitrombine aangaat (zie figuur 6). Heparine werkt door een 1000-voudige potentiering van het effect van de fysiologische stollingsremmer antitrombine (AT). Heparine bestaat uit een keten van sacharide-eenheden met een variabele lengte. De remming van trombine door heparine berust op binding van heparine aan antitrombine (AT) door middel van een unieke sequentie van vijf sacharide-eenheden (‘pentasacharide’). Daarnaast is binding van heparine aan trombine door op zijn minst 12 sacharideeenheden essentieel. Voor de remming door heparine van factor Xa is alleen binding van de pentasacharidesequentie aan antitrombine noodzakelijk. Lange heparineketens kunnen dus zowel factor IIa als factor Xa remmen, terwijl kortere ketens alleen factor Xa kunnen remmen. Op basis hiervan is duidelijk dat laagmoleculairgewichtheparine (met relatief kortere ketens) meer effectief factor Xa dan factor IIa kan remmen. Synthetische pentasachariden bestaan alleen uit een pentasacharidesequentie die aan antitrombine bindt en hebben dus exclusief factor-X-remmende eigenschappen. Door een chemische modificatie van fondaparinux is idraparinux ontstaan. Het belangrijkste verschil tussen deze middelen is de halfwaardetijd, die bij fondaparinux 15-20 uur bedraagt en bij idraparinux tot 5,5 dag kan oplopen, waardoor wekelijkse dosering mogelijk is (en subcutane toediening dus minder belastend voor de patiënt is). Fondaparinux is effectiever gebleken bij de preventie van postoperatieve trombose in vergelijking met standaard LWMH behandeling. Bij de initiële behandeling van diepe veneuze trombose (DVT) en longembolie (LE) bleek fondaparinux ten minste even effectief en veilig als behandeling met LMWH. Ook in de cardiologie bleek fondaparinux effectiever dan UFH bij ST-elevatie myocardinfarct. De langwerkende pentasacharide idraparinux is onderzocht als vervanging van de combinatie van LMWH met vitamine-K-antagonisten bij patiënten met DVT of LE. Idraparinux voldeed aan de non-inferiority-criteria bij patiënten met DVT, maar liet ook meer bloedingen zien. Voor longembolie was er voorts een twee keer verhoogde recidiefkans op VTE bij idraparinux. Het middel was daarmee inferieur aan de standaard behandeling.
Orale factor-Xa-remmers: direct small molecules (rivaroxaban en apixaban)
Rivaroxaban is een orale directe factor-Xa-remmer met een werking binnen twee uur en een halfwaardetijd van vier tot zes uur met een goede en voorspelbare biologische beschikbaarheid. Het wordt uitgeschieden via de urine en de gal. Rivaroxaban lijkt veelbelovend bij primaire profylaxe van VTE na operaties voor totale heupprothese en knieprothese, met een reductie tot 50% van VTE in vergelijking met LMWH enoxaparine, zonder toename van bloedingen (RECORD onderzoeken). De effectiviteit en veiligheid bij secundaire profylaxe van VTE (Eistein studies) is aangetoond. De resultaten over de effectiviteit bij het voorkomen van ischemische cerebrovasculaire incidenten bij atriumfibrilleren (Rocket-AF) wordt binnenkort verwacht. Recentelijk voldeed apixaban, een andere nieuwe orale selectieve factor-Xa-remmer, niet aan de criteria van het non-inferiority-design in vergelijking met LMWH enoxaparine bij de preventie van symptomatische VTE na orthopedische ingrepen, al liet het wel minder bloedingen zien. Het fase-II onderzoek bij de therapeutische behandeling van VTE lijkt wel veelbelovend met een grotere effectiviteit zonder toename van bloedingen in vergelijking met enoxaparine en warfarine. Daarnaast wordt apixaban als een van de weinige middelen in een apart onderzoek getest ter voorkoming van VTE bij patiënten met uitgezaaide maligniteit.
Directe trombineremmers
Directe trombineremmers werken onafhankelijk van antitrombine. Het prototype van de directe trombineremmer is hirudine, aanvankelijk afkomstig uit het speeksel van bloedzuigers (Hirudo medicinalis). Het wordt tegenwoordig als recombinant eiwit geproduceerd. Uit klinische onderzoeken blijkt dat recombinant hirudine en daarvan afgeleide varianten bij acute coronaire syndromen (instabiele angina pectoris en acuut myocardinfarct) en veneuze trombo-embolie een iets grotere antitrombotische effectiviteit hebben dan heparine, maar dat dit gepaard gaat met een aanzienlijk hogere kans op ernstige bloedingen. Daarnaast zijn er praktische nadelen aan deze anticoagulantia verbonden, zoals het alleen parenteraal kunnen toedienen en de noodzaak tot voortdurende monitoring van de intensiteit van antistolling. Andere parenterale directe trombineremmers zijn lepirudine en bivalirudine.
Orale directe trombineremmers: dabigatran en argatroban
Er zijn twee directe orale trombineremmers en meerdere in ontwikkeling. Dabigatran is recentelijk geregistreerd voor profylaxe van VTE na heup- en knieoperatie (Renovate, Remodel en Remobilize). Dabigatran wordt onderzocht in fase III studies bij VTE-therapie (Recover) en bij secundaire preventie (Remedy) alsook bij atriumfibrilleren (Rely) en is in deze studies non inferior of zelfs superieur ten opzichte van vitamine K antagonisten. Argatroban is door de FDA geregistreerd voor profylaxe en behandeling van VTE en dient als alternatief voor heparine bij mensen met heparine geïnduceerde trombocytopenie (HIT). Het wordt, in tegenstelling tot veel andere anticoagulantia, geheel via de lever geklaard en de halfwaardetijd is met ongeveer een uur kort. Edoxaban en betrixaban worden respectievelijk onderzocht in fase III en II trials.
Couperen van nieuwe anticoagulantia
Bij nieuwe anticoagulantia bestaat meestal geen directe mogelijkheid om te couperen, wat noodzakelijk kan zijn in het geval van een ernstige bloeding of een indicatie voor een acute invasieve ingreep. Om pentasachariden te couperen, lijkt toediening van recombinant factor VIIa de beste optie. De gebiotinyleerde vorm van idraparinux kan worden geantagoneerd met avidine. Bij gebrek aan specifieke antidota ligt de nadruk op het bereiken van lokale hemostase en voldoende transfusie met packed cells en fresh frozen plasma. In levensbedriegende situaties zou zoals vermeld recombinant factor VIIa kunnen worden overwogen.
Nieuwe antitrombotica bij speciale patiëntengroepen
Nieuwe anticoagulantia zijn doorgaans niet goed onderzocht bij mensen met bijzondere condities, die gepaard gaan met een verhoogd risico op trombose, zoals nierinsufficiëntie (klaring < 30 ml/min), zwangerschap, tijdens borstvoeding en ook niet bij patiënten met een extra hoog bloedings- of tromboserisico.
Tabel 1: Belangrijkste indicaties voor gebruik van vitamine-K-antagonisten
| Belangrijkste indicaties voor gebruik van vitamine-K-antagonisten |
|---|
| Preventie van veneuze trombo-embolie (diepe veneuze trombose en longembolie) |
| Behandeling van veneuze trombo-embolie |
| Preventie van arteriële embolie en kleptrombose bij mechanische kunstkleppen |
| Preventie van arteriële embolie bij atriumfibrilleren en andere hartritmestoornissen |
| Perifere vaatziekten en cerebrovasculaire accidenten in specifieke gevallen |
Tabel 2: (Relatieve) contra-indicaties voorvitamine-K-antagonisten
| Tabel 2: (Relatieve) contra-indicaties voorvitamine-K-antagonisten |
|---|
| Leverinsufficiëntie |
| Nierinsufficiëntie |
| Hemorragische diathese en ernstige trombopenie |
| Ernstige (ongecontroleerde) hypertensie |
| Recente bloedingsproblemen, zoals intracerebrale bloedingen en maagulcera |
| Overgevoeligheid voor cumarinederivaten |
Tabel 3: (Ralatieve) contra-indicaties voor heparine
| Tabel 3: (Ralatieve) contra-indicaties voor heparine |
|---|
| Hemorragische diathese en ernstige trombopenie |
| Recent of actief bloedverlies uit maag-darmstelsel (<1 week) |
| Recentelijk doorgemaakte intracerebrale bloeding (<3 maanden) |
| Recentelijk doorgemaakte (<4 maanden) heparinegeïnduceerde trombocytopenie (HIT) |
| Ernstige level- of nierinsufficiëntie |
| Ernstige (ongecontroleerde) hypertensie |
| Recente bloedingsproblemen, zoals intracerebrale bloedingen en maagulcera |
| Overgevoeligheid voor cumarinederivaten |
| Geplande uitvoering van invasieve ingrepen, zoals lumbaalpunctie, operatie aan hersenen, ruggenmerg, ogen |
| Recent trauma aan centraal zenuwstelsel of hersenen |
Tabel 4: Dosering van ongefractioneerde heparine
| aPPT-ratio* | Aanpassing heparinedosis in IE/uur | Extra | Nieuwe APTT |
|---|---|---|---|
| <1,3 | +150 IE/uur | Bolus 5000 IE | Na 6 uur |
| 1,3-1,5 | +100 IE/uur | - | Na 6 uur |
| 1,5-2,0 | - | - | Volgende dag |
| 2,0-2,5 | -50 IE/uur | - | Volgende dag |
| 2,5-3,0 | -100 IE/uur | Pomp 30 min. stilzetten | Na 6 uur |
| >3,0 | -150 IE/uur | Pomp 60 min. stilzetten | Na 6 uur |
| |||
[[File:Figuur_5_-_nieuwe_anticoagulantia.svg|thumb}}